今回学習すること
- 原子量
- 原子量の計算
板書見本

原子量
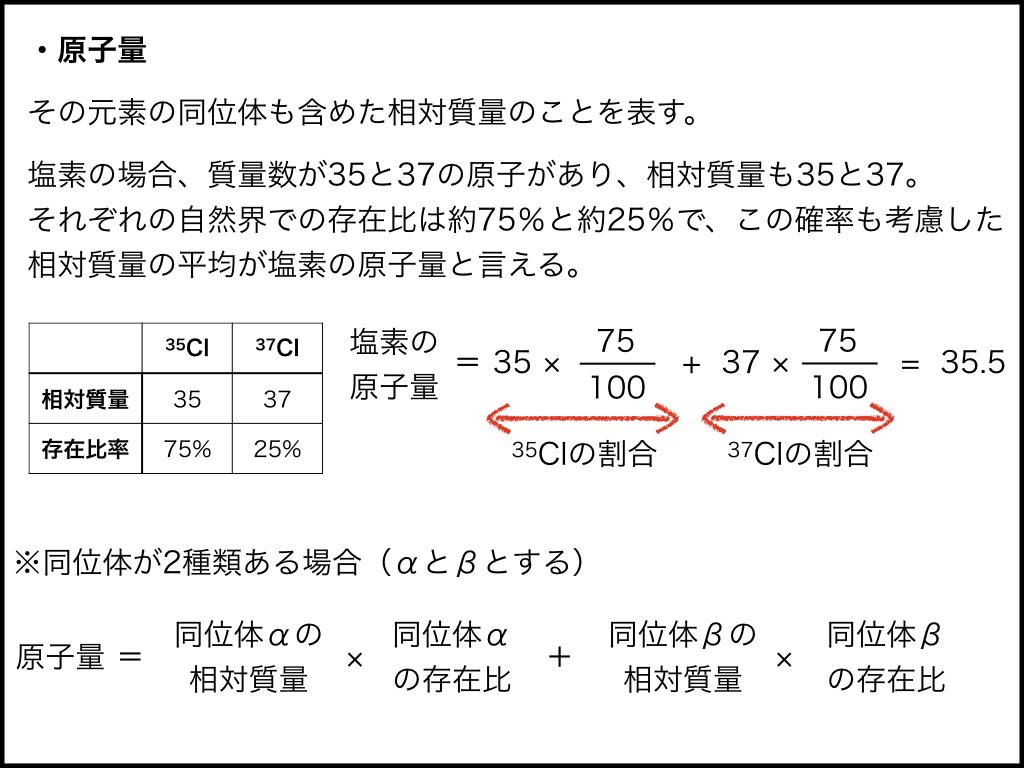
原子量とはその元素の同位体も含めた原子の相対質量を表しています。
例えば、塩素の場合は質量数が35の塩素と質量数が37の塩素の2種類の同位体が一般的に知られている。ここで、それぞれの相対質量を計算してみると質量数35の塩素の相対質量は35、質量数37の塩素の相対質量は37となります。
一言に塩素といってもこの35の塩素と37の塩素が存在することになるので、塩素の本当に重さはどちらなのか、という疑問が浮かびます。
実は、自然界において同位体は存在する比が決まっています。そのため塩素には質量数が35と37の2種類があるので、単純に間をとって相対質量を36とすることはできません。同位体について、実際の存在比を考えて計算された相対質量のことを原子量と呼んでいます。

原子量を簡単に言うと、原子の平均相対質量ということです。
質量数35の塩素の存在比は約75%、質量数37の塩素の存在比は残りの約25%です。
そのため、存在比に応じた原子量を求める計算式は次のようになります。
※同位体が2種類ある場合(AとBとする)
原子量 = 同位体Aの相対質量 × 同位体Aの存在比 + 同位体Bの相対質量 × 同位体Bの存在比
なぜ同位体のことを考えなければいけないのか。
同位体とは、同じ陽子数で異なる中性子数を持つ原子のことです。

同じものなのに重さが微妙に違う。一卵性双生児(DNAは同じ)の関係性に似ていますね。
原子を構成する粒子である陽子と中性子と電子の質量の関係は、次のようになっています。
陽子の質量(1.673×10-24g) ≒ 中性子の質量(1.675×10-24g)
このことから、質量数の差が原子の質量に影響を与えます。
極端な例で言うと、1H(陽子数:1、中性子数:0)と2H(陽子数:1、中性子数:1)の場合、
同じ水素なのに質量が倍異なるということになります。
質量に対する電子の影響
また、電子の数は基本的に質量に影響を与えません。
陽子の質量(1.673×10-24g)>> 電子の質量(9.109×10-28g)
ということから、が陽子と中性子の質量に比べると1/1840と、あまりにも小さいことが原因です。
基本的に原子は「陽子数 = 電子数」となるので、現在確認されている元素の中で最も陽子数が大きいのが陽子数118のオガネソンです。それでも電子数は118個しかないので、陽子の118/1840個分という誤差の範囲内の影響しか与えません。

イオンの場合も質量は変化しますが、イオンの価数は基本的には1〜3なので、
最大でも3/1840という省略されてしまう程度でしか影響を与えられません。
原子量の計算
原子量の計算問題で出題される形式は主に2つです。
1つ目はシンプルに相対質量と存在比率が与えられていて原子量を求める問題です。
計算式にそのまま代入するだけで解くことができます。
2つ目は1つ目の問題と逆で、相対質量と原子量が判明していて、存在比を求める問題です。
この問題でよく間違えるのは、式に代入する存在比をxとyなど2つの変数で立式してしまう場合です。
この時、式は1つなのに変数は2つになってしまい、解くことができません。
もう一つの式として「 x + y = 100 」を考えなくてはいけません。
結果的には同じことですが、同位体が2つであれば片方の存在比をxと置くと、
もう片方は「残り」ということなので、全体の100からxを引いた存在比になると考えておいた方が、
混乱しにくいでしょう。
次回学習すること
- 分子量
- 分子量の計算




コメント