今回学習すること
- 相対質量について
- 相対質量の計算
板書見本

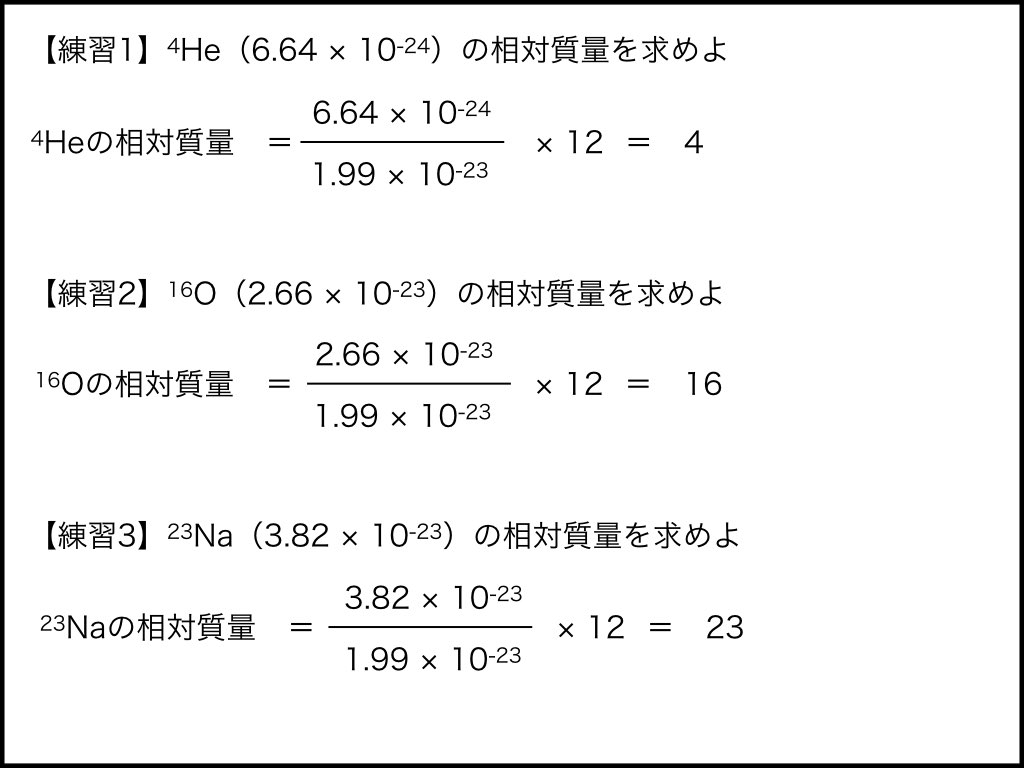
原子の相対質
原子は英語ではatom(アトム)と呼ばれ、物質を構成する基本的な粒子です。
原子1粒の質量は非常に小さく、最も軽い水素原子の質量は1.67 × 10-24gとなります。
10-24は1杼(1の後に0が24個)分の1を表しています。
杼とは千、万、億、兆、京、垓の次の単位です。
そのため、あまりにも質量が小さく、0も多すぎるため、数字を見ただけではどちらが軽くてどちらが重いのか、どのぐらい差があるのかがわかりにくいという現象が起こってしまいます。
そのため、もっとわかりやすい基準を設けて、その比を相対的な値として質量の比較をするようになりました。この相対的な質量のことを原子の相対質量と呼び、基準は質量数12の炭素で、その重さを12と定めました。
基準となる元素と基準値は、O=100など様々なものが考案されましたが、端数の少なさや計算の簡単さを考慮し最終的には1961年に炭素が基準となったようです。
相対質量の計算式は「求めたい原子の質量」÷「炭素の質量」、最後に「12」をかけることで相対質量を求めることができます。この計算式で水素の相対質量を求めると相対質量は1となります。
最も軽い原子である水素が最小の整数である1となるので、炭素の相対質量=12というのは分かりやすい基準だと言えるでしょう。

相対質量はあくまでも比の話なので、g(グラム)などの単位は付きませんよ
相対質量の計算
例題として3つの問題を用意しました。
基本的には先程の式に代入するだけで良いのですが、各原子の相対質量を求める時に注意するべき点が2つあります。
1つ目は「分子と分母の数字が逆になりやすい」ことです。
高校生にまでなると忘れていがちですが、分数はそもそも「分子の数の中に分母の数がいくつあるのか」を判断する数式です。次の画像のような関係性があります。
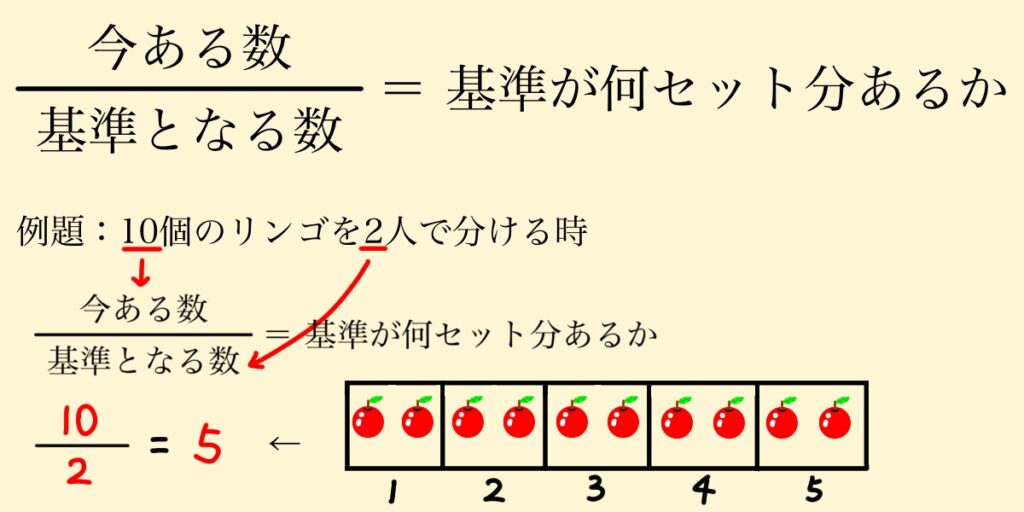
計算があっているかどうかは、簡単で分かりやすい例に置き換えて計算すると間違いを防げます。
この場合は、分母と分子を逆にすると2個を10人で分けることになってしまうので、答えは0.2です。
流石に、10個を2人で分けようとしたのに0.2個しかないのはおかしいと気付けるはずです。
分数の意味を再度確認してみても良いかもしれません。
2つ目は「×12」を書き忘れないことです。
もし、「×12」がないと分母と分子の両方に炭素の質量を代入した時におかしさに気付けます。両方とも同じ数なので、答えは1。炭素は基準で相対質量が12と定められているのに1が出てくるのはおかしいので、「×12」が必要である、ということにも言及すると良いかもしれません。
次回学習すること
- 原子量
- 原子量の計算



コメント